செய்முறை, கணக்கீடு, எடுத்துக்காட்டு - கெல்டால்முறை | 11th Chemistry : UNIT 11 : Fundamentals of Organic Chemistry
11 வது வேதியியல் : அலகு 11 : கரிம வேதியியலின் அடிப்படைகள்
கெல்டால்முறை
நைட்ரஜனை அளந்தறிதல்: நைட்ரஜனை அளந்தறிய இருமுறைகள் உள்ளன. அவையாவன 1.டுமாஸ் முறை 2. கெல்டால் முறை.
கெல்டால்முறை
இம்முறை டுமாஸ் முறையை விட எளிதில் கையாளக்கூடியதாகும். உணவுப் பொருள்கள், உரங்கள் போன்றவற்றின் பகுப்பாய்விற்கு பெருமளவில் இம்முறை பயன்படுகிறது. நைட்ரஜன் அடங்கிய கரிமச்சேர்மத்தினை அடர் H2SO4 உடன் சேர்த்து சூடுபடுத்தும் போது, அதிலுள்ள நைட்ரஜன் ஆனது அம்மோனியம் சல்பேட்டாக மாறுகிறது. பின்னர் உருவான கரைசலை அதிக அளவு காரத்துடன் சேர்க்கும் போது வெளிப்படும் அம்மோனியா வாயுவானது அதிக அளவு திட்ட அமிலத்தால் உறிஞ்சப்படுகிறது. பயன்படுத்தப்பட்ட திட்ட காரத்தினை நடுநிலையாக்க தேவைப்படும் அமிலத்தின் கனஅளவினை தரம் பார்த்தலின் மூலம் கண்டறியலாம். இதிலிருந்து வெளியேறிய அம்மோனியாவின் அளவு கண்டறியப்பட்டு நைட்ரஜனின் எடை அறியப்படுகிறது. (படம்:11.3))
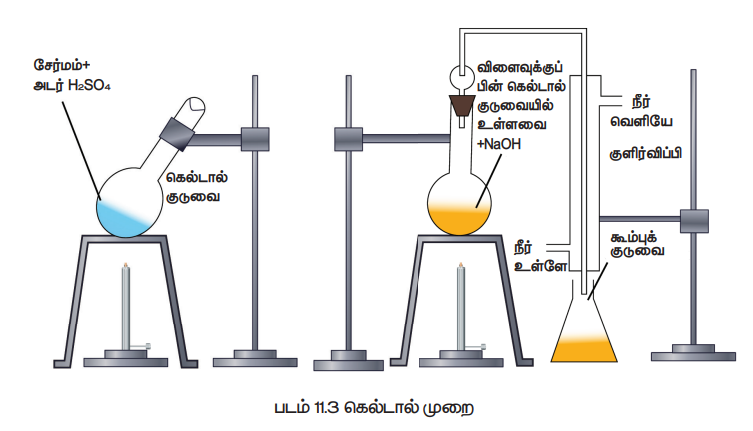
செய்முறை:
நீண்ட கழுத்துடைய பைரக்ஸ் கண்ணாடியால் ஆன கெல்டால் குடுவையில் எடைத்தெரிந்த கரிமச்சேர்மம், சிறிது K2SO4 , வினையூக்கியான CuSO4 , சுமார் 25ml அடர் H2SO4 ஆகியன எடுத்துக்கொள்ளப்படுகின்றன. பின் குடுவை கண்ணாடி குமிழியால் தளர்வாக மூடப்பட்டு சாய்வாக வைக்கப்பட்டு, மிதமாக சூடுபடுத்தப்படுகிறது. முதலில் கரைசல் பழுப்பு நிறமாகி, பின் முன்பிருந்தது போன்ற தெளிவான கரைசல் உருவாகும் வரை சூடுபடுத்தப்படுகிறது இந்நிலையில் நைட்ரஜன் முழுவதும் (NH4)2 SO4 ஆக மாற்றப்படுகிறது. பின் கெல்டால் குழாய் குளிர்விக்கப்பட்டு அதிலுள்ளவை நீர்க்கப்பட்டு, பின்னர் ஒரு லிட்டர் கனஅளவுள்ள குடுவைக்கு கரைசல் மாற்றப்படுகிறது. குடுவையின் பக்கவாட்டின் வழியே அதிக அளவு NaOH கரைசல் சேர்க்கப்படுகிறது. பின்குடுவையானது, கெல்டால் சேகரிக்கும் அமைப்பு மற்றும் நீர்க்குளிர்விப்பான் ஆகியவற்றுடன் பொருத்தப்படுகிறது. குளிர்விப்பானின் கீழ்முனை கணக்கிடப்பட்ட கன அளவைக் கொண்ட அதிகளவு N/20 H2SO4 கரைசலில் வைக்கப்படுகிறது. குடுவையிலுள்ள நீர்மம் பின் கொதிக்கவைக்கப்படுகிறது. மேலும் இதனால் வெளியேற்றப்பட்ட அம்மோனியா வாலை வடிக்கப்பட்டு, சல்பியூரிக் அமிலத்தால் உறிஞ்சப்படுகிறது. கரைசல் நன்கு கொதிக்கும் போது, காரம் தெறிக்காமல் கெல்டால் சேகரிக்கும் அமைப்பு தடுக்கிறது.
அம்மோனியா வெளியாவது நிறைவுற்ற பின் (கரைசல், சிவப்பு லிட்மஸால் சோதனை செய்யப்பட வேண்டும்) சேகரிப்பான் நீக்கப்படுகிறது. அதிகப்படியான அமிலம் பீனாப்தலீன் நிறங்காட்டியை பயன்படுத்தி, காரத்துடன் தரம் பார்க்கப்படுகிறது.
கணக்கீடு
கரிம சேர்மத்தின் எடை = Wg.
வெளிவிடப்பட்ட NH3 வாயுவை முழுமையாக நடுநிலையாக்க தேவைப்படும் H2SO4 ன் கன அளவு = V mL.
NH3 யை நடுநிலையாக்க தேவைப்படும் H2SO4 ன் திறன் = N
உருவான NH3 ன் கனஅளவு V1 எனவும் செறிவு N1 எனவும் கொள்க. எனவே V1N1 = VN
கரிமச் சேர்மத்தில் உள்ள நைட்ரஜனின் எடை
= 14 × NV / 1 × 1000 × w
நைட்ரஜனின் சதவீதம் = (14× NV/100× w) × 100%
எடுத்துக்காட்டு - 6;
கெல்டால் முறைக்கு உட்படுத்தப்பட்ட 0.6g எடையுள்ள கரிம சேர்மத்தால் வெளியிடப்பட்ட NH3 வாயு 50ml செமி நார்மல் (semi normal) H2SO4 ஆல் உறிஞ்சப்படுகிறது. மீதமுள்ள அமில கரைசல், வாலை வடிநீரால் நீர்க்கப்பட்டு, கரைசலின் கனஅளவு 150 மிலி ஆக மாற்றப்படுகிறது. 20 மி.லி நீர்க்கப்பட்ட கரைசலை முழுமையாக நடுநிலையாக்க 35 மிலி (N/20) NaOH கரைசல் தேவைப்பட்டது எனில், நைட்ரஜனின் சதவீதத்தை கணக்கீடு.
கரிம சேர்மத்தின் எடை = 0.6g
எடுத்துக்கொண்ட H2SO4 ன் பருமன் = 50 மி.லி
எடுத்துக்கொண்ட H2SO4 ன் திறன் = 0.5 N
வினைபுரியாத, 20ml நீர்த்த H2SO4 அமிலக் கரைசல், 35ml 0.05N சோடியம் ஹைட்ராக்சைடு கரைசலால் நடுநிலையாக்கப்பட்டது எனில்,
நீர்க்கப்பட்ட சல்ஃபியூரிக் அமிலத்தின் திறன்
= 35 × 0.05 / 20
= 0.0875 N
கரிம சேர்மத்துடன் வினைபட்டு எஞ்சிய
H2SO4 ன் பருமன் = V1 mL
H2SO4 ன் திறன் = 0.5N
நீர்க்கப்பட்ட H2SO4 ன் பருமன் = 150 mL
நீர்க்கப்பட்ட சல்ஃபியூரிக் அமிலத்தின் திறன் = 0.0875 N
V1 = 150 × 0.087 / 0.5 = 26.25 mL
அம்மோனியாவால் உறிஞ்சப்பட்ட H2SO4 ன் பருமன் = 23.75 mL
23.75 mL 0.5 N H2SO4 ≡ 23.75 mL 0.5N NH3
0.6g கரிமச் சேர்மத்தில் நைட்ரஜனின் எடை

= 27.66 %